هدف گیری ژن کلیدی می تواند منجر به درمان سندرم داون گردد
به گزارش وبلاگ کاتالوگ و بروشور، بر اساس تحقیقی که به وسیله دانشگاه راتگرز راهنمایی شده، هدف قرار دادن یک ژن کلیدی قبل از تولد می تواند روزی یاری کند به این که، با معکوس کردن رشد مغزی جنینی غیرطبیعی و بهبود عملکرد شناختی پس از تولد، منجر به یک درمان برای سندروم داون گردد.
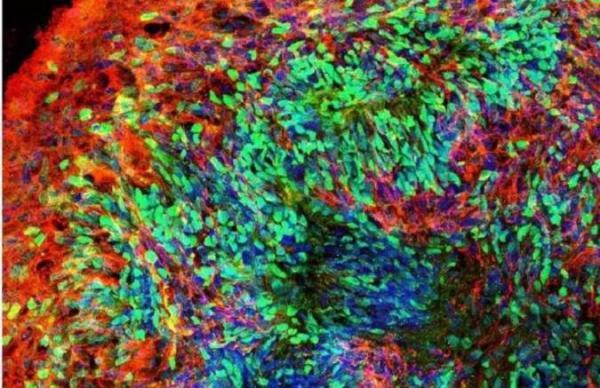
یک مدل اُرگانوید سه بعدی زنده از مغز، فراوری شده از سلول های بنیادی انسان سندرم داون. اعتبار: رنجی چو / راتگرز دانشگاه-نیوبرانزویک
بر اساس تحقیقی که به وسیله دانشگاه راتگرز راهنمایی شده، هدف قرار دادن یک ژن کلیدی قبل از تولد می تواند روزی یاری کند به این که، با معکوس کردن رشد مغزی جنینی غیرطبیعی و بهبود عملکرد شناختی پس از تولد، منجر به یک درمان برای سندروم داون گردد.
بر طبق مطالعه ای در مجله سلول بنیادی سلول، برای تحقیق توسعه مغزی اولیه پیوند خورده با سندروم داون، محققان با استفاده از سلول های بنیادی که می توانند به دیگر سلول های مغز تبدیل شوند، دو مدل آزمایشی را توسعه داده اند: یک مدل ارگانوید سه بعدی زنده مغز و یک مدل مغز موش با سلول های کاشته شده انسان. مطالعه بر روی ژن OLIG2 کروموزوم 21 انسان متمرکز بود.
پنگ جیانگ، استادیار گروه زیست شناسی سلولی و علوم اعصاب در دانشگاه راتگرز- نیوبرونزویک، گفت: نتایج ما نشان می دهد که ژن OLIG2 به طور بالقوه یک هدف درمانی عالی پیش از تولد برای معکوس کردن توسعه مغز جنینی غیر نرمال، و تعادل مجدد بین دو نوع نورون در مغز - تحریک نماینده و مهار نماینده - است، و وجود یک تعادل سالم، حیاتی است همچنان که بهبود عملکرد شناختی پس از زایمان مهم است.
معمولا نوزاد با چهل و شش کروموزوم متولد می گردد، اما نوزادان مبتلا به سندرم داون یک کپی اضافی از کروموزوم بیست و یک دارند. به گفته مراکز کنترل و جلوگیری از بیماری های ایالات متحده آمریکا، این امر این که بدن و مغز کودک چگونه رشد کند را تغییر می دهد، که این می تواند منجر به چالش های ذهنی و جسمی گردد. سندرم داون شایع ترین شرایط کروموزومی در ایالات متحده است که در حدود یک نوزاد از هر هفت صد نوزاد را تحت تأثیر قرار می دهد و حدود شش هزار نوزاد در هر سال تحت این شرایط به جهان می آیند.
محققان، سلولهای پوستی که از بیماران مبتلا به سندرم داون جمع آوری شده اند را به دست آوردند، و از لحاظ ژنتیکی، آن سلول ها را بازبرنامه ریزی کردند به سلول های بنیادی تحریک شده انسانی پلوریپوتنت (hiPSC ها). بر اساس نظر مؤسسات ملی سلامت، این سلول های خاص در مشابهت با سلول های بنیادی جنینی می توانند به انواع مختلفی از سلول ها، از جمله سلول های مغزی، در خلال زندگی و رشد اولیه توسعه یابند و ابزارهای مفیدی برای توسعه دارو و مدل سازی بیماری هستند.
دانشمندان با استفاده از سلولهای مغزی استخراج شده از سلول های بنیادی با یک کپی اضافی از کروموزوم 21، مدل ارگانویدی مغز 3 بعدی را که شبیه مغز انسانی در حال رشد اولیه است، توسعه دادند. آنها بعلاوه مدل مغز موش را، با سلول های مغز انسان استخراج شده از سلول های بنیادی، کاشته شده در مغز موش در طی یک روز پس از تولد موش ها، توسعه دادند. آنها دریافتند که نورون های مهار نماینده - که عملکرد مغز را هموار می سازد - در هر دو مدل بیش از حد فراوری شده است و در موش های بالغ حافظه را مختل نموده است. آنها بعلاوه دریافتند که ژن OLIG2 نقش مهمی در این اثرات دارد و این که مهار آن منجر به بهبود می گردد.
ترکیبی از مغز مدل های ارگانوید مغز و مغز موش می تواند برای مطالعه سایر اختلالات عصبی مانند اختلال طیف اوتیسم استفاده گردد. این امر بعلاوه ممکن است به دانشمندان یاری کند تا مکانیسم های بیماری آلزایمر را بهتر درک نمایند. جیانگ اشاره نمود که بیماران مبتلا به سندرم داون اغلب مبتلا به بیماری آلزایمر زودرس هستند.
دانشمندان یک مدل موشی را برای بیماری مغزی نادر سندرم ژوبرت توسعه می دهند
مخچه موش رنگ آمیزی شده برای نورون های Purkinje (سبز). اعتبار: اندرو بشفورد و واسنتان سوترامانیان.
یک مدل موشی تازه برای سندرم ژوبرت به وسیله دانشمندان دانشگاه Bath پیشرفته است که امیدوار هستند تحقیقات برای فهمیدن چگونگی توسعه بیماری و بعلاوه یاری به توسعه و ارزیابی روینمودهای درمانی را تسریع کند.
محققان از گروه زیست شناسی و بیوشیمی توانستند این سندروم را در موش ها به دقت بازسازی نمایند و این کار را به وسیله حذف هدف گیری شده بخش هایی از یک ژن به نام Talpid3 که برای شکل گیری تاژک - پیش آمدگی های موی مانند مشهود در بسیاری از سلول های پستانداران - ضروری است انجام دادند. معمولا نوزاد با چهل و شش کروموزوم متولد می گردد، اما نوزادان مبتلا به سندرم داون یک کپی اضافی از کروموزوم بیست و یک دارند. این پیش آمدگی ها شبیه آنتن های سلولی عمل می نمایند و سیگنال های خارجی را حس می نمایند. ژن معادل انسانی، KIAA0856، در مطالعات گذشته، با این بیماری مرتبط تشخیص داده شده است.
دستکاری ژن انتخابی در Talpid3 باعث بازفراوری اختلالات فیزیکی بیماری در مخچه موش ها شده است. موشهای جهش یافته هم یکی از علائم اصلی سندرم ژوبرت را نشان دادند که یک آتاکسیای پیش رونده، یعنی یک عدم کنترل محرک بدتر شونده، است. علاوه بر این، حذف در Talpid3، بر بعضی از مسیرهای مولکولی کلیدی مرتبط با تشکیل مخچه تاثیر گذاشت.
این مقاله در مجله آسیب شناسی منتشر شده است.
سندرم ژوبرت یک بیماری ژنتیکی ارثی نادر است که به طور میانه 1 نفر را در بین 80000 تا 100000 نفر تحت تأثیر قرار می دهد. این بیماری منجر به رشد ناکامل مخچه می گردد که منطقه ای از مغز است که کنترل تعادل و مهارت های حرکتی را به عهده دارد. بیماران از طیف وسیعی از علائم رنج می برند، اغلب اختلال در کنترل حرکتی، تنفس و خواب غیر نرمال، و تاخیر رشد و بعلاوه ناهنجاری هایی مانند شکاف کام یا انگشتان و پنجه های اضافه دارند.
دکتر واسانتا سوبرامانیان، که این تحقیق را با دکتر اندرو بشفورد راهنمایی کرد، گفت: ما معتقدیم که مدل موشی ما برترین رونوشت سندرم ژوبرت را تا به امروز نشان می دهد و به همین علت یک مدل آزمایشگاهی عالی برای دانشمندان در مطالعه این بیماری و هم جستجوی درمان های تازه خواهد بود.
با هدف گیری انتخابی ژن Talpid3، ما اختلالات مغزی مشخصه سندرم ژوبرت و نشانه هایی مانند آتاکسیا را بازفراوری کردیم. ما بر این باوریم که حذف Talpid3 بر سیگنالینگ و مهاجرت سلولی در مغز اثر می گذارد، که باعث اختلال در ساختار سلولی مخچه می گردد که چیزی است که ما در تحقیقاتمان به آنالیز آن ادامه خواهیم داد.
منبع: دانشگاه راتگرز
منبع: راسخون